السوائل
1- تأخذ شكل الوعاء الذي توجد فيه ولكنها تحتفظ بحجمها ثابتا.
2- لا تمدد لتملأ الوعاء.
3- جسيماتها قريبة ومتراصه في حجم ثابت.

1- الكثافة والضغط :
– تكون السوائل أكثر كثافة من الغازات عند درجة حرارة 25 وضغط جوي 1atm
– كثافة السوائل أكبر كثيرا من أبخرتها عند الظروف الجوية نفسها.
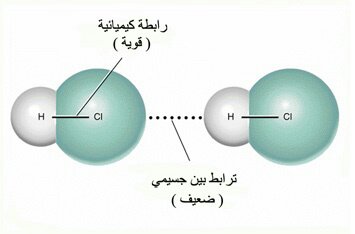
– يعود الارتفاع في كثافة السوائل إلى القوى بين الجزيئية التي تربط الجسيمات معا.
– تختلف السوائل عن الغازات في أنها تعد غير قابلة للضغط في كثير من التطبيقات و التغير في حجمها صغير جدا لان جسيماتها متراصة بإحكام.

2- الميوعة :
– تصنف الغازات والسوائل على أنها موائع بسبب قابليتها للانسياب والانتشار.
– تنتشر السوائل أبطأ من الغازات عند درجة الحرارة نفسها.
– السوائل أقل ميوعة من الغازات.

3- اللزوجة :
هي مقياس مقاومة السائل للتدفق والانسياب ، جسيماتها السائلة قريبة من بعض قوى التجاذب بينها تبطئ من حركتها.
1- قوى التجاذب
كلما كانت القوى بين الجزيئات قي السوائل كبيرة زادت درجة لزوجتها.
2- حجم الجسيمات و شكلها
– يؤثر حجم جسيمات المادة وشكلها في لزوجتها.
– تكون لزوجة الجسيمات ذات السلاسل الطويلة في تركيبها مثل الزيت أكبر لزوجة من الجسيمات ذات السلاسل القصيرة.
– تكون المسافات في السلاسل الطويلة بين ذرات الجسيمات المتجاورة قصيرة جدا فتصبح فرصة حدوث تجاذب بين الذرات أكبر.
3- درجة الحرارة
– تنخفض اللزوجة مع ارتفاع درجة الحرارة.
– إن زيادة درجة الحرارة تزيد الطاقة الحركية لجسيمات الزيت وتساعد هذه الطاقة الجسيمات على التغلب على القوى بين الجزيئية وتمنعها من الانسياب.
– يعد زيت المحرك الذي يقلل من احتكاك الأجزاء المتحركة فيه مثالا آخر على تأثير درجة الحرارة في اللزوجة.

4- التوتر السطحي :
هي الطاقة اللازمة لزيادة مساحة سطح السائل بمقدار معين وهذه الظاهرة مقياس لمقدار قوة السحب إلى الداخل بوساطة الجسيمات الموجودة داخل السائل.
– كلما زادت قوى التجاذب بين الجسيمات زاد التوتر السطحي.
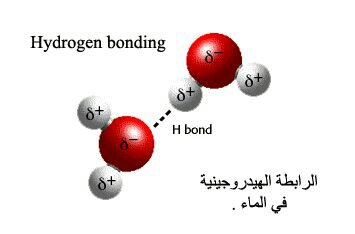
– للماء توتر سطحي عال بسبب قدرة جسيماته على تكوين روابط هيدروجينيه متعددة.
– قطرات الماء كروية الشكل لأن مساحة سطح القطرة الكروية أصغر من مساحة سطح أي شكل آخر له الحجم نفسه.
– تسمى المركبات التي تعمل على خفض التوتر السطحي للماء عوامل خافضة للتوتر السطحي.
5- التماسك و التلاصق :
التماسك : يصف قوة الترابط بين الجسيمات المتماثلة.
التلاصق : يصف قوة الترابط بين الجسيمات المختلفة.
– هناك نوعان مهمان للقوى : التماسك والتلاصق
– لأن قوى التلاصق بين جسيمات الماء وثاني أكسيد السليكون في الزجاج أكبر من قوى التماسك بين جسيمات الماء لذا يرتفع الماء على طول الجدران الداخلية للانابيب الاسطوانية.
– الخاصية الشعرية :
– تسمى الأنابيب الرفيعة الأنابيب الشعرية.
– تسمى حركة ارتفاع الماء داخل هذه الأنابيب الخاصية الشعرية التي تفسر سبب امتصاص المناديل الورقية لكميات كبيرة من الماء.
نور عبدالله 2/2ع
《المواد الصلبة》.
كيمياء الحالة الصلبة هي فرع من فروع الكيمياء يتم فيه دراسة الخصائص الفيزيائية للمواد الصلبة، إضافةً إلى بنيتها وطرق اصطناعها.
حسب نظرية الحركة الجزيئية فإن لمول واحد من جسيمات الماده الصلبه كمية الطاقة الحركية نفسها الموجودة في مول واحد من الماده السائلة او الغازيه عند درجة الحراره نفسها.
ولكي تبقى المادة في الحالة الصلبة عند درجة حرارة معينة لابد من وجود قوى تجاذب قوية بين جسيماتها ولهذا السبب لا تعتبر الماده الصلبه مائعاً بينما يمكن تصنيف السوائل والغازات على انها موائع.
– كثافة المواد الصلبه: تكون جسيمات المادة الصلبه قريبه من بعضها البعض اكثر من جسيمات المادة السائلة،ولأن جسيمات المواد الصلبه متقاربة ومتراصة فإن مقداراً عادياً من الضغط لن يحدث تغييراً في حجمها.
١//المواد الصلبة البلورية هي مادة ذراتها او ايوناتها او جزيئاتها مرتبة في شكل هندسي منتظم،ويمكن تمثيل مواقع الجسيمات في البلورة في صورة نقاط ضمن إطار يسمى الشبكه البلورية.
“وحدة البناء”.
هي اصغر ترتيب للذرات في الشبكة البلورية يحمل التماثل نفسه ووحدة البناء هي نموذج مصغر من البناء الاكبر الكامل.
هناك٧تصنيفات للبلورات بناء على الشكل…
١]هالايت”مكعب”.
٢]فيزوفيانايت”رباعي الاوجه’.
٣]اراجونايت”متوازي مستطيلات”.
٤]ميكروكلاين”ثلاثي الميل”.
٥]تورمالين”سداسي الأوجه”.
٦]زمرد”معيني”
٧]كروسيت”احادي الميل”.
\\أنواع المواد الصلبة البلورية//.
١-الصلبة الذريه:
-وحدة الجسيمات “الذرات”.
-خصائص الحالة الصلبه “لينة الى لينة جداً،درجة انصهار منخفضة،رديئة التوصيل”.
٢-الصلبة الجزيئية:
-وحدة الجسيمات “جسميات”.
-خصائص الحالة الصلبه “متوسطة اللين،تتفاوت درجات الانصهار بين المنخفصه والمرتفعه نسبياً،رديئة التوصيل”.
٣-الصلبة التساهمية الشبكيه:
-وحدة الجسميات “ترتبط الذرات بروابط تساهمية”.
-خصائص الحاله الصلبة “صلبة جداَ،درجة الانصهار مرتفعه،رديئة التوصل عادة”.
٤-الصلبة الايونية:
-وحدة الجسميات “الذرات يحيط بها الكترونات التكافؤ الحرة الحركة”.
-خصائص الحالة الصلبه “لينة الى صلبه،درجة الانصهار بين المنخفضة والمرتفعه،قابلة للسحب والطرق،ممتازة التوصيل”.
٢// المواد الصلبة غير المتبلوره هي المواد التي لا تترتب فيها الجسيمات بنمط مكرر ومنتظم ولا تحتوي على بلورات وتتكون هذه المواد عادةً عندما تبرد المواد المنصهره بسرعه كبيره…”مثال”
١-الزجاج ٢-المطاط٣-والكثير من المواد البلاستيكية.
زينب أحمد 2/2ع